Adaptogenne działanie leków nootropowych w stresie doświadczalnym u zwierząt.
В.И. Ахапкина
Zakład Farmakologii Doświadczalnej i Klinicznej, “Отечественные лекарства”, Moskwa
Wprowadzenie
Wieloletnie doświadczenie w badaniach i praktycznym stosowaniu leków nootropowych, w warunkach ekstremalnych, pozwala sądzić, że ta grupa leków najlepiej spełnia wymagania stawiane lekom neurotropowym podczas stosowania w złożonych warunkach aktywności zawodowej człowieka.
Szeroki zakres wskazań do stosowania klinicznego, wyjątkowo niska toksyczność i brak negatywnych skutków ubocznych, czynią środki nootropowe bardzo porządanymi w zastosowaniu w specjalistycznych dziedzinach medycyny.
Na poziomie molekularnym leki tego typu mają przede wszystkim działanie antyhipoksyjne i ergotropowe (aktywacja metabolizmu energetycznego w komórkach mózgu), z czym wiąże się ich działanie nootropowe (poprawa funkcji poznawczych i intelektualnych), aktoprotekcyjne (zwiększenie wytrzymałości na stres fizyczny) i detoksykacyjne. Na poziomie neuronalnym realizuje się stymulujące, depresyjne lub neurostabilizujące działanie leków nootropowych, które może przejawiać się jako działanie psychostymulujące, uspokajające, przeciwdepresyjne, przeciwdrgawkowe, eufunkcyjne i inne.
Połączenie działania antyhipoksyjnego i ergotropowego z jednym lub kilkoma efektami neuro- i psychotropowymi znacznie poszerza obszar zastosowania przedstawicieli tej klasy leków. W praktyce medycyny ekstremalnej leki nootropowe o działaniu polimodalnym są stosowane zarówno jako farmakoterapia zaburzeń i chorób czynnościowych, jak i do farmakologicznej korekty stanu zmęczenia. Opierając się na poglądach o czołowej roli ośrodkowego układu nerwowego w regulacji aktywności adaptacyjnej oraz biorąc pod uwagę specyficzne właściwości farmakologiczne leków nootropowych, można przyjąć, że ich stosowanie jest w stanie mieć nie tylko działanie przeciwstresowe, ale i adaptogenne.
Celem naszej pracy było porównawcze badanie wpływu leków nootropowych na odpowiedź na stres u szczurów.
Materiały i metody
Badania przeprowadzono na 1050 samcach szczurów rasy Wistar o masie 180-250 g; zwierzęta pozyskano z centralnego ośrodka hodowli Akademii Medycznej w Stołbowie. Przed przystąpieniem do badań zwierzęta były adaptowane przez 14 dni. W okresie wiosennym nie przeprowadzano doświadczeń.
Przeprowadzono ocenę porównawczą 8 leków – Seduxen (diazepam), Phenibut i jego izomery, Pantogam (kwas gopantenowy), Pyriditol (pirytinol), Piracetam i Phenotropil. Leki podawano dootrzewnowo raz dziennie w ściśle tym samym czasie (± 5 minut). Badanie przeprowadzono w sposób metodą podwójnie ślepej próby. Jako kontrola służyły szczury w tych samych warunkach doświadczalnych otrzymujące roztwór fizjologiczny (2 ml/100 g masy ciała) lub wodę destylowaną (1 ml/100 g masy ciała).
Do oceny wpływu leków na wyznaczniki reakcji stresowej zwierząt wykorzystano trzy modele stresu doświadczalnego o umownych nazwach: stres “bólowy”, ” emocjonogenny” i “antyortostatyczny” [7, 8].
Po zakończeniu doświadczeń zwierzęta usypiano eterem i określano masę grasicy, śledziony i nadnerczy. Ponadto badano żołądek pod kątem obecności wrzodów i zmian krwotocznych [9].
Oznaczano poziom kortyzolu we krwi w modelu działania stresu “antyortostatycznego”. W tej serii badań zwierzęta były zabijane przez dekapitację gilotyną, a do badania pobierano krew.
Uzyskane wyniki poddano analizie statystycznej. Wiarygodność różnic pomiędzy porównywanymi parametrami oceniono za pomocą testu t-Studenta. Różnice na poziomie istotności 95% przy p < 0,05 uznano za istotne.
Wyniki i ich omówienie
W warunkach stresu bólowego (unieruchomienie z elektryczną stymulacją tylnych kończyn) ochronne działanie przeciwstresowe leków mogło być wywierane poprzez działanie przeciwbólowe lub uspokajające. We wcześniejszych badaniach na myszach stwierdzono, że leki nootropowe podwyższają próg wrażliwości na ból. Najsilniejszy efekt miały fenibut i fenotropil.
W warunkach stresu emotogennego do stymulacji szczurów poruszających się swobodnie na platformie z podłogą z elektrodami stosowano prąd zmienny, którego napięcie zwiększano o 2 V co 15 sekund w parach, tak aby utrzymać u zwierząt stan agresji niezależnie od progu bólu. Przy stosowaniu tej techniki wykluczono możliwość ochronnego antystresowego działania leków, ze względu na efekt przeciwbólowy, ponieważ intensywność stymulacji elektro-bólowej ulegała ciągłej zmianie, podążając za zmianą reaktywności emocjonalnej zwierząt. W wyniku 30-minutowej sesji drażnienia, zwierzęta utrzymywały przez 3 dni ten sam stopień napięcia emocjonalnego, objawiający się agresją skierowaną przeciwko sobie.
Gdy szczurom zapewniono pozycję antyortostatyczną z kątem pochylenia głowy -45° (antientostatic hypokinesia – ANOG -45°) przez 3 dni w ciasnych klatkach karnych, wykluczono również możliwość ochronnego działania antystresowego poprzez efekt przeciwbólowy, gdyż w tym wariancie stresu czynnik bólowy był nieobecny.
We wszystkich trzech modelach stresu u zwierząt kontrolnych (tych, które otrzymywały roztwór fizjologiczny lub wodę destylowaną) obserwowano te same zmiany: zmniejszała się masa grasicy, zwiększała się masa nadnerczy i występowały wrzody żołądka.
Wskaźnikiem skuteczności leków był ” wskaźnik ochronny”, który obliczano jako różnicę między całkowitym wskaźnikiem zmian w błonie śluzowej żołądka w grupie zwierząt kontrolnych, przyjętym jako jednostka, a tym samym wskaźnikiem w grupie zwierząt otrzymujących leki. Maksymalny wskaźnik ochrony mógł być równy jeden. Zerowa wartość indeksu wskazywała na brak działania, a wartość ujemna na wzrost zmian w żołądku pod wpływem badanego leku.
Piracetam
Indeks ochronny piracetamu (ryc. 1) dla modeli stresu “bólowego”, “emotiogennego” i “antyortostatycznego” wynosił odpowiednio 0,65, 1,0 i 0,52. Tym samym piracetam miał największe działanie ochronne w “emotiogennym” wariancie stresu.
Pantogam
Pantogam pod względem działania ochronnego zbliżył się do piracetamu (0,58, 0,87 i 0,50). Wskaźnik ochronny piryditolu w modelach stresu wynosił 0,62, 0,70 i 0,56; a fenibutu 0,76, 0,89 i 0,99. Fenibut miał największy efekt ochronny w “antyortostatycznej” wersji stresu. Nowy lek nootropowy Phenotropil działał podobnie jak Phenibut, ale przy użyciu niższych dawek. Jego wskaźniki ochronne wynosiły 0,72, 0,99 i 1,0. Całkowicie zapobiegał zmianom neurogennym błony śluzowej żołądka w “antyortostatycznym” wariancie stresu i miał stosunkowo wysoki efekt ochronny w stresie ” emocjonogennym”.
Seduxen (diazepam)
Wskaźnik ochronny Seduxenu wynosił 0,31, -0,71 i 0,71 odpowiednio dla wariantów stresu “bólowego”, ” emocjoniogennego” i “antyortostatycznego”. Największe działanie ochronne seduksenu zaobserwowano w warunkach stresu “antyortostatycznego” [6], natomiast model stresu ” emocjonogennego” nasilał stopień uszkodzenia błony śluzowej żołądka. Działanie ochronne preparatu wyrażało się w zmniejszeniu stopnia uszkodzenia błony śluzowej żołądka w warunkach unieruchomienia w połączeniu z działaniem nocyceptywnym (receptorowym) oraz w warunkach hipokinezji antyortostatycznej. W warunkach stresu ” emocjonogennego”, gdy jednym z czynników ekstremalnych staje się obciążenie fizyczne, Seduxen nasilał stopień natężenia zmian destrukcyjnych w błonie śluzowej żołądka. Przyczyną braku efektu ochronnego w tym ostatnim przypadku może być ośrodkowy efekt miorelaksacyjny Seduxenu, który zmniejsza tolerancję na wysiłek fizyczny. Pokrywa się to z wynikami badań G. Lukhanina (1981), który dość szczegółowo badał wpływ Seduxenu na przebieg reakcji stresowej.
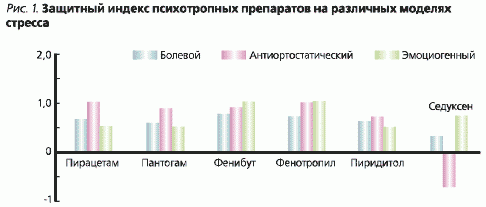
W warunkach zachowań agresywno-obronnych nootropy wykazywały podobny efekt ochronny.
Efekt ochronny nootropów w różnych warunkach ekstremalnych wynika prawdopodobnie z połączenia działania neurostabilizującego i adaptogennego, przejawiającego się w zapobieganiu rozwojowi wrzodów żołądka, przy zachowaniu niezbędnego poziomu aktywności neurowegetatywnych mechanizmów regulacji adaptacyjnej, zapewniających funkcje troficzne układu nerwowego [1-3, 5].
W trakcie całego badania masa ciała zwierząt we wszystkich grupach doświadczalnych w ANOG -45° istotnie się zmniejszyła, a w grupie kontrolnej vivar – nieznacznie wzrosła (tab.). Numery grup odpowiadały badanym preparatom w następującej kolejności: 1 – vivar control; 2 – kontrola z solą fizjologiczną; 3 – piracetam 100 mg/kg; 4 – piracetam 200 mg/kg; 5 – fenotropil 25 mg/kg; 6 – fenotropil 50 mg/kg; 7 – fenotropil 100 mg/kg; 8 – fenibut 50 mg/kg; 9 – fenibut 100 mg/kg.
Tabela
Dynamika masy ciała szczurów w 3-dniowym ANOG -45°.
| Grupa | Przed eksperymentem, g | Dni eksperymentu | ||
| 1 | 2 | 3 | ||
| 1 | 229,6 ± 3,8 | 235,1 ± 2,9 | ||
| 2 | 229,0 ± 3,6 | 201,0 ± 4,7 р < 0,001 | 182,0 ± 4,3 р < 0,001 | 160,0 ± 3,5 р < 0,001 |
| 3 | 216,5 + 2,9 | 198,5 ± 2,7 р < 0,001 | 177,8 ± 1,9 р < 0,001 | 167,0 ± 2,4 р < 0,001 |
| 4 | 224,5 ± 3,6 | 190,5 ± 3,2 р < 0,001 | 173,0 ± 3,7 р < 0,001 | 161,5 ± 3,5 р < 0,001 |
| 5 | 230,0 ± 3,6 | 208,5 ± 4,7 р < 0,001 | 183,5 ± 4,3 р < 0,001 | 145,3 ± 1,4 р < 0,001 |
| 6 | 234,5 ± 3,6 | 209,0 ± 4,7 р < 0,001 | 196,0 ± 3,2 р < 0,001 | 174,2 ± 3,4 р < 0,001 |
| 7 | 236,5 ± 4,6 | 223,0 ± 4,5 р < 0,001 | 208,0 ± 4,7 р < 0,001 | 183,9 ± 3,6 р < 0,001 |
| 8 | 232,4 ± 3,2 | 205,4 ± 4,7 р < 0,001 | 188,0 ± 4,5 р < 0,001 | 171,0 ± 2,3 р < 0,001 |
| 9 | 229,0 ± 3,6 | 202,0 ± 4,7 р < 0,001 | 187,0 ± 4,3 р < 0,001 | 173,0 ± 3,7 р < 0,001 |
Badane środki nootropowe nie zapobiegły wzrostowi poziomu kortyzolu we krwi w porównaniu z kontrolą vivar, ale znacząco go zmniejszyły w stosunku do poziomu kortyzolu we krwi w grupie zwierząt, które otrzymywały tylko sól fizjologiczną (ryc. 2).
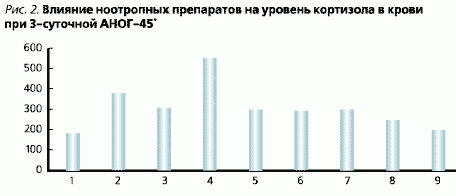
Zgodnie z teorią G. Selje (1936), stres aktywuje podwzgórze i wytwarza hormony uwalniające, które pobudzają syntezę i uwalnianie hormonów przysadkowych (ACTH, TSH i in.). Pod wpływem ACTH warstwa korowa nadnerczy wydziela glikokortykoidy, które w dużych ilościach tłumią grasicę i węzły chłonne. W naszych badaniach obserwowaliśmy również znaczne zmniejszenie masy grasicy u zwierząt poddanych stresowi (ryc. 3).
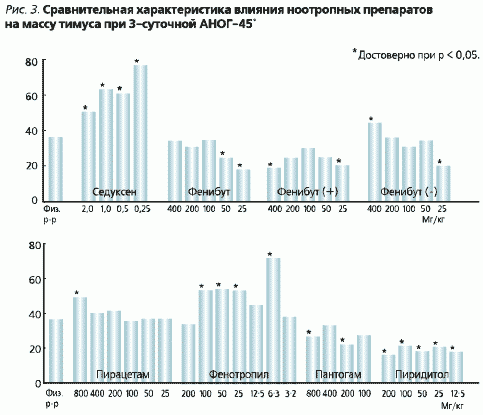
Fenibut
Fenibut zapobiegał inwolucji (zmniejszeniu) grasicy tylko w “bolesnym” wariancie stresu. W warunkach ANOS -45° nie miał wpływu na masę tego narządu, a jego lewoskrętny izomer zwiększał masę grasicy o 7% w porównaniu z grupą kontrolną zwierząt leczonych roztworem fizjologicznym. Piracetam w dawce 800 mg/kg częściowo zapobiegał inwolucji grasicy w warunkach ANOS (wzrost masy o 13,0% w stosunku do kontroli).
Phenotropil
Nowy lek nootropowy Phenotropil* miał największy efekt w warunkach stresu “antyortostatycznego”. Zapobiegał on inwolucji grasicy w tym modelu w zakresie dawek od 6,3 do 100 mg/kg. Największy efekt lek wykazywał w dawce 6,3 mg/kg, zapobiegając inwolucji grasicy o 36% (ryc. 3).
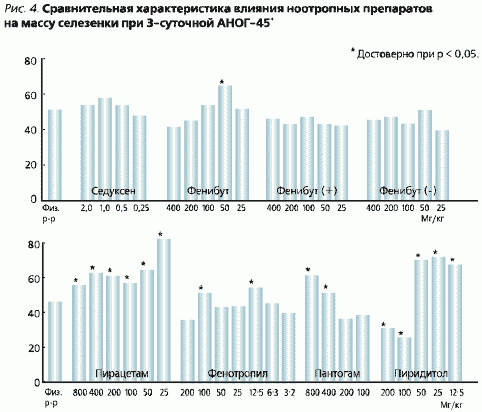
Badane preparaty miały różny wpływ na masę śledziony, która zmniejszyła się o 34 % u zwierząt leczonych kontrolą fizjologiczną w porównaniu z kontrolą vivar. Seduxen nie zapobiegał jej zmniejszeniu w porównaniu z roztworem fizjologicznym (ryc. 4). Fenibut zwiększył masę śledziony jedynie w dawce 50 mg/kg (o 16 %). Fenibut (+) i fenibut (-) nie miały wpływu na zmniejszenie masy tego narządu. Aktywność Phenotropilu i Pantogamu była na tym samym poziomie co Phenibutu. Piracetam i Pyriditol zapobiegały inwolucji śledziony w sposób zależny od dawki, a w dawce 25 mg/kg piracetam zwiększał masę śledziony o 19% w porównaniu z kontrolą vivar.
Dane dotyczące wpływu badanych leków na przerost nadnerczy przedstawiono na rycinie 5. 5. Pod ANOS efekt działania fenibutu i jego izomerów zmniejszał się wraz ze wzrostem dawki. W dawkach 25, 50 i 100 mg/kg fenibut zmniejszał przerost nadnerczy odpowiednio o 13, 32 i 9 % w porównaniu z jego poziomem u zwierząt otrzymujących sól fizjologiczną. Fenibut (+) w dawkach 50 i 100 mg/kg zmniejszał ten wskaźnik odpowiednio o 24 i 14 %. Fenibut (-) w tych dawkach zmniejszał przerost nadnerczy o 19 %. We wszystkich pozostałych dawkach zwiększał przerost średnio o 53 %. Piracetam we wszystkich dawkach zwiększał przerost nadnerczy.
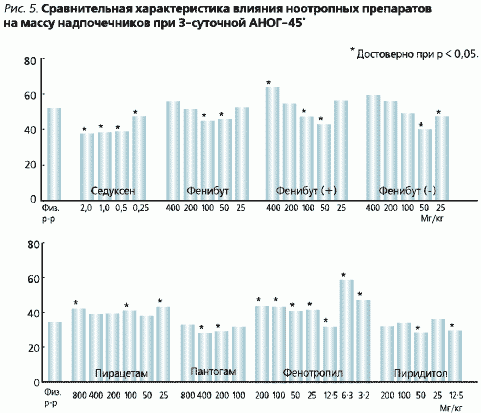
Seduxen całkowicie hamował przerost nadnerczy. Cechą mechanizmu działania Seduxenu jest to, że nie wpływając na stałe odruchy, hamuje on tworzenie połączeń nerwowych w początkowych etapach formowania się funkcjonalnego systemu regulacji emocjonalnej, w odpowiedzi na działanie bodźca. Nie zmieniając reakcji odruchów warunkowych i percepcji sygnałów zmysłowych, Seduxen całkowicie tłumi hamujące działanie napięcia emocjonalnego, poprawia poprawność przełączania odruchów warunkowych [4]. W porównaniu z innymi lekami uspokajającymi preparat ten charakteryzuje się największą uniwersalnością działania na dysfunkcje wegetatywne typu centralnego i wegetatywne korelaty stresu emocjonalnego, bez zmiany przystosowawczych reakcji hemodynamicznych (V.A. Belyakova, 1980; T.M. Vysokovsky, V.I. Kurilenko, 1981).
Wnioski
Dane przedstawione w niniejszej pracy jednoznacznie wskazują, że leki nootropowe o różnym spektrum aktywności farmakologicznej wykazują ten sam efekt adaptogenny. W przeciwieństwie do leków uspokajających nie hamują one odpowiedzi organizmu na stres, lecz regulują adekwatność odpowiedzi do siły bodźca, zwiększając w ten sposób odporność zwierząt na stres. Efekt adaptogenny leków nootropowych rozwija się już po jednorazowym zastosowaniu. Efekt ten zależy od dawki. Należy również zauważyć, że do uspokajających lub psychostymulujących komponentów działania leków nootropowych nie można podchodzić z punktu widzenia ogólnie przyjętych farmakologicznych i klinicznych zasad rozumienia tych efektów. Jest to widoczne w działaniu Fenibutu, określanego jako lek uspokajający, oraz Fenotropilu, który ma silny psychostymulacyjny komponent działania. Jednak oba leki, w zależności od dawki i stanu organizmu, wykazują zarówno działanie uspokajające, jak i psychostymulujące.
Istnieją podstawy, aby sądzić, że efekt adaptogenny leków nootropowych jest bezpośrednio związany z ich działaniem nootropowym i najwyraźniej można go uznać za jeden z głównych testów farmakologicznych tej grupy leków. Przeprowadzone badania pozwalają na rozróżnienie pojęć działania “streso-ochronnego” (antystresowego) i “adaptogennego”. Stłumienie przez leki uspokajające odpowiedzi OUN na reakcję stresową jest klasycznym przejawem ochrony biernej, czyli przykładem działania stresoprotekcyjnego (antystresorowego). Zachowanie pod wpływem leków nootropowych odpowiedniego poziomu funkcji mnemotechnicznych mózgu pozwala na wytworzenie “aktywnej ochrony” w warunkach narażenia na stres, zwiększając tym samym odporność organizmu i jego zdolności adaptacyjne.
Adaptogenne działanie Phenotropilu jest dodatkowym dowodem na jego nootropowe właściwości, pomimo obecności wyraźnego efektu psychostymulacyjnego tego leku. Jednak w przeciwieństwie do psychostymulantów, Phenotropil, podobnie jak inne klasyczne nootropy, przyczynia się do zachowania, a nie wyczerpania rezerwowych zdolności organizmu w warunkach stresu i jest w stanie dostosować adekwatność reakcji w zależności od natężenia stresu.
Zakończenie
W pracy przedstawiono wyniki naszych badań eksperymentalnych nad wpływem leków nootropowych na reakcję stresową u szczurów na różnych modelach stresu. Wykazano, że nootropy, w przeciwieństwie do klasycznego leku chroniącego przed stresem Seduxen (diazepam), nie tłumią reakcji stresowej, ale mają działanie adaptogenne, zwiększające odporność zwierząt na wpływy eksperymentalne. Wyróżniono pojęcia “stresoprotekcyjnego” i “adaptogennego” działania leków.
LITERATURA
- Ахапкина В.И. (Кaлоша В.И.), Станишевская А.В. и др. Всесоюзный съезд фармакологов // Тез. докл.: Ереван, 1982. С. 371–372.
- Ахапкина В.И..(Кaлоша В.И.), Полевой Л.Г. и др. VII Всесоюзная конференция по космич. биолог. и авиакосм. мед. // Тез. докл.: Калуга, 1982. С. 247.
- Ахапкина В.И. (Кaлоша В.И.), Полевой Л.Г. Биохимия, фармакология, медицинское применение производных витаминов и других предшественников коферментов: Сб. ст.: Иркутск, 1983, С. 194.
- Вальдман А.В., Козловская М.М., Медведев О.С. Фармакологическая регуляция эмоционального стресса. М., 1979. 358 с.
- Гончаров И.Б., Ахапкина В.И. XXIII Совещание постоянно действующей рабочей группы по космической биологии и медицине. Интеркосмос, Кошице, ЧСФР, 1990. С. 50.
- Зоря Л.В. Влияние седуксена на течение экспериментальной гипокинезии // Косм. биол. и авиакосм. мед. 1977. Т. 11. № 6. С. 68–73.
- Коваленко Е.А., Гуровский Р.Н. Гипокинезия. М., 1980. 320 с.
- Модели и методы изучения экспериментальных и эмоциональных стрессов. Волгоград, 1977. 130 с.
- Селье Г. Очерки об адаптационном синдроме. М., 1960. 253 с.
* Produkt jest opatentowany w Federacji Rosyjskiej jako lek nootropowy i antydepresyjny. Znak towarowy PHENOTROPIL jest zarejestrowany w Federacji Rosyjskiej i w innych krajach.